Att forska av rätt skäl: vägen framåt
HANDLINGSPLAN:
EXEMPEL PÅ VAD DU SOM PATIENT KAN GÖRA
- Fundera på vilka frågor om behandlingseffekter som du tycker är viktiga. Lär dig att känna igen osäkerhet: ta ordet, ställ frågor, begär ärliga svar.
- Var inte rädd för att fråga din läkare om vilka behandlingsmetoder som finns, vad som kan hända om du väljer en viss behandling och vad som kan hända om du inte gör det
- Var skeptisk till påståenden och uppgifter i medier om ”genombrott” för nya behandlingar, och till hur ”statistik” redovisas i medierna – särskilt siffror i rubriker!
- Ifrågasätt behandlingsmetoder som enbart bygger på förutfattade meningar eller vaga förhoppningar och saknar vetenskapligt stöd.
- Se upp med onödiga sjukdomsstämplar och överdiagnostik. Ta reda på om ett tillstånd innebär en hög eller låg risk för dig. Fråga vad som kan hända om man väntar lite med behandlingen.
- Om du ska delta i en behandlingsstudie, kontrollera att forskningsprotokollet är registrerat och offentliggjort, att protokollet hänvisar till systematiska översikter som visar att studien behövs, och att samtliga resultat kommer att publiceras i sin helhet och skickas till alla deltagare som vill ha dem.
- Stöd och samarbeta med vårdpersonal, forskare, forskningsfinansiärer och andra som försöker främja forskning om viktiga kunskapsluckor – otillräckligt belysta frågor.
- Sprid kunskap om riskerna med snedvriden forskning. Försök påverka politiker och andra opinionsbildare så att de inser att träning i sådan källkritik bör finnas på skolschemat.
Den medicinska forskningen har utan tvivel bidragit till högre livskvalitet och längre liv. Men vi menar att de kommersiella krafter och akademiska aktörer som driver på forskningen inte har gjort tillräckligt för att identifiera och fokusera på det som patienterna tycker är viktigt.
Enorma summor läggs varje år ner på medicinsk forskning i världen. Men merparten av de drygt hundra miljarder dollar som det handlar om satsas på laboratorie- och djurförsök och inte på studier som patienterna kan ha direkt nytta av.
Inte ens när man ska avgöra vilka behandlingseffekter som ska studeras tar man hänsyn till det som patienterna tycker är viktigast. Läkemedelsindustrins ekonomiska resurser ger dem makt att påverka forskningens inriktning. Företagen kan betala exempelvis tusentals pund eller dollar för varje patient som rekryteras till deras behandlingsstudier. Det gör att forskarna och deras institutioner alldeles för ofta medverkar i studier som tar upp frågor som är intressantare för industrin än för patienterna.
Mycket pengar slösas tyvärr bort i olika stadier av forskningsprocessen. Det har flera orsaker: Man ställer fel forskningsfrågor och utför onödiga eller dåligt planerade studier. Man publicerar inte forskningsresultaten eller gör dem bara delvis tillgängliga. Man skriver vinklade och meningslösa forskningsrapporter. Det här borde engagera alla: forskare, finansiärer, behandlare, skattebetalare och, framför allt, patienterna.
Innan vi börjar skissa på en bättre framtid vill vi sammanfatta de viktigaste åtgärderna för att göra forskningen bättre. Man måste
- ställa rätt forskningsfrågor
- planera och genomföra forskningsprojekt på rätt sätt
- publicera alla resultat och göra dem tillgängliga
- skriva opartiska och meningsfulla forskningsrapporter.
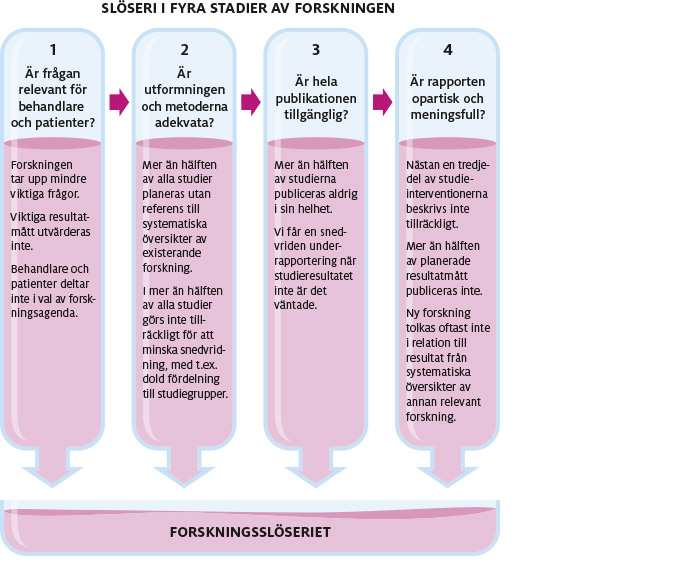
Figur 14. Hur forskningsmedel slösas bort i olika stadier av processen [1]
1. Att ställa rätt forskningsfrågor
Ibland är läkaren inte säker på vilken behandling som är bäst för patienten eftersom de alternativ som finns inte har studerats tillräckligt. Läkemedelsindustrin och forskningsinstitutionerna brukar inte vara särskilt intresserade av studier som patienterna tycker är betydelsefulla. Men om vi inte får svar på viktiga frågeställningar kan det få allvarliga konsekvenser. Vi kan ta ett exempel: ökar eller minskar chansen att överleva för patienter med traumatisk hjärnskada om de behandlas med kortisonpreparat? Den här metoden hade varit etablerad i årtionden när en väl utformad studie visade att sådan behandling vid hjärnskada förmodligen har lett till tusentals dödsfall.[2] Men när forskarna lade fram ansökan om studien motarbetades de först av läkemedelsindustrin och ett antal universitetsforskare. Varför? Jo, de som invände var upptagna av ekonomiskt lönsamma studier av nya, dyra läkemedel och ville inte ha konkurrens om deltagare till sina forskningsprojekt. De här studierna undersökte nya så kallade nervskyddande läkemedel som mätte effekter av tveksam betydelse för patienterna.
Ett annat skäl till att vi måste ta itu med obesvarade frågor är att det minskar slöseriet med knappa sjukvårdsresurser. Ett exempel på slöseri är den lansering av human albuminlösning i form av intravenöst dropp som gjordes på 1940-talet. Man trodde att behandlingen skulle förhindra dödsfall bland brännskadade och andra allvarligt sjuka patienter. Men konstigt nog prövades inte teorin i rättvisande studier förrän på 1990-talet. Den systematiska översikt som då gjordes av alla aktuella randomiserade studier hittade inga bevis för att human albuminlösning minskade dödsrisken mer än vanlig saltlösning. Faktum är att översikten visade att om albuminlösning alls hade någon effekt så ökade den snarare dödsrisken.[3] De här fynden ledde till att läkare i Australien och Nya Zeeland genomförde den första tillräckligt stora och rättvisande jämförande studien av human albuminlösning och saltlösning.[4] Studien, som borde ha utförts femtio år tidigare, visade att albuminlösning inte är bättre än saltlösning. Eftersom albumin är ungefär tjugo gånger så dyrt som saltlösning innebär det ett enormt slöseri med sjukvårdsresurser under de senaste femtio åren.
2. Att planera och genomföra forskningsprojekt på rätt sätt
Flera undersökningar har visat att många rapporter om behandlingsstudier håller dålig kvalitet. Därför har man utvecklat regler för hur forskningsresultat ska redovisas. Man ska bland annat ange hur många patienter som tillfrågats om att delta i studien och hur många som avböjt. Resultaten ska dessutom presenteras för de behandlingsgrupper som valdes när studien inleddes. Trots reglerna finns det fortfarande mycket att göra för att förbättra (a) valet av forskningsfrågor, (b) sättet att formulera frågorna så att det man väljer att utvärdera är sådant som patienterna tycker är viktigt, och (c) den information som patienterna får ta del av. (Se Relevant och bra forskning är allas ansvar och Hur kan sjukvården bli bättre?)
För att ta reda på om en tänkt studie är möjlig och lämplig att genomföra, kan man utföra preliminära studier med patientgrupper. Det gör att man lättare hittar eventuella brister i planeringen. Man ser också vad som är mest intressant att utvärdera och upptäcker om projektet kanske inte är värt att fullfölja.[5, 6]
Det här kan spara mycket tid, pengar och frustration. Vi kan ta exemplet med den behandlingsstudie av män med lokaliserad prostatacancer som vi beskrev i Relevant och bra forskning är allas ansvar. Studiens utformning blev mycket bättre efter att man noga tänkt igenom hur läkarna skulle beskriva syftet och behandlingsalternativen för patienterna. Genom att undersöka hur patienter upplevde situationen insåg man vad männen som hade inbjudits till studien behövde veta och vad de oroade sig för. På så sätt fick forskarna hjälp att utforma den information som sedan gavs till tänkbara deltagare.[7]
3. Att publicera alla resultat och göra dem tillgängliga
Att bara redovisa delar av forskningsresultatet kan innebära en kraftig snedvridning av kunskapsläget. Resultat från vissa studier publiceras aldrig därför att de inte blev så som forskarna eller finansiärerna hade förväntat sig. Om sådana studier aldrig avrapporteras försvinner de spårlöst.[8] Ett annat problem är selektiv rapportering, det vill säga att man bara redovisar vissa studieresultat och väljer bort andra som inte ger stöd åt den behandlingsmetod som undersökts.[9] Patienter lider och dör på grund av snedvridna forskningsrapporter om behandlingseffekter. Detta är både oetiskt och ovetenskapligt.
4. Att skriva opartiska och meningsfulla forskningsrapporter
Men även när studier publiceras saknar de ofta viktig information som kunde ha gjort det lättare för läsarna att bedöma och tillämpa undersökningsfynden. En översikt av 519 randomiserade studier publicerade i ansedda tidskrifter i december 2000 visade att 82 procent av studierna inte beskrev processen med blindad fördelning, medan 52 procent inte informerade om hur man hade gjort för att minska felaktig registrering och mätning. I Rättvisande behandlingsstudier beskrev vi båda dessa faktorer som avgörande för en bra studie.[10] Den bristfälliga rapporteringen gäller även hur man beskriver de behandlingsmetoder som använts. En studie visade till exempel nyttan med att ge ett informationshäfte till patienter med känslig tarm, IBS (irritable bowel syndrome), jämfört med att inte göra det. Däremot beskrev inte forskarna vad häftet innehöll eller hur man kunde få tag i det. Andra patienter och läkare utanför forskningsprojektet kunde därför inte använda ”behandlingen”. Det här är bara ett av många exempel från en granskning av artiklar i ledande tidskrifter, en granskning som visade att ungefär var tredje artikel saknade den typen av avgörande information.[11]
Det är dessutom ovanligt att forskare sätter sina nya resultat i deras sammanhang och jämför med tidigare, liknande undersökningar. Utan sådan grundläggande information (som vi beskrev i Utvärdering av all relevant och tillförlitlig dokumentation) är det omöjligt att veta vad resultaten faktiskt betyder. Hur stort det här problemet är, framgår av en större granskning som gjordes vid 3 tillfällen under 12 år. Av 94 rapporter från randomiserade studier, publicerade i 5 ledande medicintidskrifter åren 1997–2009, hade bara 26 (det vill säga 27 procent) hänvisat alls till systematiska översikter av liknande studier. Bara 3 av rapporterna hade uppdaterat befintliga översikter med de nya resultaten, så att man kunde se hur den samlade kunskapsbilden hade påverkats. Under de här åren fanns det inget som tydde på att situationen höll på att bli bättre. Följden kan bli att beslut om behandling styrs av vilken tidskrift som läkaren har råkat läsa.
Färdplan mot en bättre framtid
Medicinsk forskning skulle kunna bedrivas av rätt skäl, och studierna skulle kunna genomföras och redovisas på ett bra sätt. Inget av de enskilda förslag som beskrivs här nedan är nytt. Men om patienter och vårdpersonal lyckas ta ett samlat grepp om frågorna kan våra åtta förslag utgöra en skiss till en färdplan som kan ge oss bättre medicinsk forskning och behandling.
1. Visa hur man bedömer tillförlitligheten i påståenden om behandlingseffekter
Om saker och ting ska kunna förändras måste människor bli mer medvetna om hur systematiska fel och slumpens inverkan kan förvränga resultat om behandlingseffekter. God forskning ska upptäcka och minimera felkällor, men detta är knappast något som folk i allmänhet känner till. Det krävs särskilda åtgärder för att ändra på detta, utbilda människor och se till att sådana frågor tas upp redan i skolan.
2. Satsa på systematiska översikter av studier av behandlingsmetoder
Man besvarar många frågor om behandling genom att systematiskt gå igenom befintlig forskning, uppdatera de översikter som redan finns och sprida resultaten till vårdpersonal och patienter. Idag tar det för lång tid innan resultat från nya studier läggs in i systematiska översikter. Ett viktigt mål för vården bör vara att åtgärda den här bristen genom att samla, sammanställa och sprida kunskap om behandlingseffekter.
3. Var öppen med ovisshet kring behandlingsmetoder
Vårdpersonal kan ha svårt att berätta att det råder osäkerhet om behandlingsmetoder, och patienter vill kanske inte alltid få reda på det. I stället invaggas man i en falsk trygghet, okunnig om att det vetenskapliga stödet är osäkert. Om vårdpersonal och patienter ska kunna förbättra situationen tillsammans måste båda parter inse att dåligt utvärderade behandlingar kan göra stor skada. Alla behöver lära sig mer om hur forskningen ska läggas upp för att resultaten ska bli tillförlitliga. Och vi måste hitta de bästa strategierna för att det ska lyckas.
4. Satsa på forskning om frågor som patienter och personal vill ha svar på
De som finansierar forskning och de som bedriver den inriktar sig främst på grundforskning som kan gagna patienter först långt fram i tiden, och forskning som gynnar läkemedelsindustrins ekonomiska intressen. Så kallad klinisk behandlingsforskning, en tillämpad forskning om frågor som ingen tjänar pengar på men som ändå är viktig för patienterna, måste konkurrera om anslag (även när det gäller offentliga medel), och kostnaderna kan vara höga. Vi måste göra mer för att ta reda på vilka frågor som patienter och vårdpersonal ställer om behandlingsmetoder, och se till att forskningsfinansiärer tar hänsyn till detta och prioriterar studier som kan täppa till kunskapsluckorna.
5. Var konsekvent i fråga om samtycke till behandlingsstudier
Vårdpersonal som törs konstatera att vissa behandlingseffekter är osäkra, och som därför vill bedriva forskning i vården, måste vara mer strikta med att informera patienter än vad deras icke-forskande kollegor behöver vara. Detta kan verka ologiskt. När det råder en genuin osäkerhet om effekten av behandlingar borde det vara regel att göra randomiserade studier eller andra rättvisande utvärderingar. Att delta i behandlingsstudier borde inte beskrivas som mer riskfyllt än ordinarie vård, eftersom det skulle kunna tolkas som att rutinerna i den ordinarie vården alltid är säkra och effektiva.
6. Förbättra forskarvärldens hantering av kunskap
Många blir förvånade när de hör att forskare inte måste sammanställa befintlig kunskap när de ska ansöka om finansiering och etiskt godkännande av en ny studie. Följden är att det fortfarande görs alldeles för många dåligt upplagda och rent ut sagt onödiga studier, både ur etiskt och vetenskapligt perspektiv. Vi borde försöka förmå forskningsfinansiärer och etikprövningsnämnder att kräva systematiska översikter av befintlig forskning innan nya studier får påbörjas. Nya forskningsrapporter borde inledas med en hänvisning till systematiska översikter som beskriver varför ytterligare forskning behövs, och de borde avslutas med att redovisa hur det nya resultatet påverkar den samlade bilden.
7. Inför publiceringsregler som minskar risken för snedvridning
För att få bukt med snedvriden publicering behöver man införa vissa regler för hur en studie ska inledas. När man påbörjar en studie ska man registrera den och offentliggöra forskningsprotokollen så att de kan granskas. Detta är mycket viktigt, eftersom man annars inte kan kontrollera att en studie har genomförts i enlighet med sitt protokoll. När studien avslutas ska man publicera samtliga resultat och göra rådata tillgängliga för kritisk granskning och fortsatt analys. Man bör exempelvis kontrollera att de utfallsmått som presenteras är desamma som angetts i försöksprotokollet.
8. Kräv öppenhet om kommersiella bindningar, jäv och andra intressekonflikter
Det finns numera påtagliga bevis för att ekonomiska intressen och andra särintressen ibland går före patientintresset när man lägger upp, genomför, analyserar, tolkar och tillämpar forskning. Detta undergräver det ömsesidiga förtroende som behövs för att forskningen ska kunna gagna patienterna på bästa sätt. Vi bör kräva av alla inblandade parter, från kommersiella företag till patientorganisationer, att de öppet redovisar om de har andra intressen än patienternas välbefinnande.
Vi måste göra något nu
Det har länge varit dags för en nyordning inom behandlingsforskningen. Om vårdpersonal och patienter agerar tillsammans är de åtgärder vi föreslår i högsta grad genomförbara. Det finns skäl att kräva en förändring – nu.
![]() EN GUIDE TILL SÄKER VÅRD
EN GUIDE TILL SÄKER VÅRD
Socialstyrelsen har gett ut en handbok för patienter som har eller kan få upprepade kontakter med vården. Syftet är att man som patient ska bli mer delaktig och kunna medverka till en trygg och säker vård. Handboken ger många goda råd om hur man kan förbereda sig inför samtal med vårdpersonal, undersökningar och behandlingar. Här följer några exempel på frågor som man kan vilja ha svar på.När det gäller prover och undersökningar kan man bland annat behöva få veta (och fråga):
- Varför tas provet?
- Varför görs undersökningen?
- Finns det några risker?
- Finns det andra alternativ?
Som patient har man också rätt att få information om vilken eller vilka behandlingar man kan få och om man kan välja mellan olika metoder. Man ska få information om syftet med behandlingen, hur den går till, eventuella biverkningar eller andra risker och vilket resultat man kan förvänta sig på kort och lång sikt.
När det gäller val av behandlingsmetod kan man till exempel fråga:
- Vilka behandlingsalternativ finns det?
- Vilka är för- och nackdelarna?
- Vad händer om jag inte får någon behandling?
- Finns det några biverkningar eller risker med behandlingen?
- Hur vet jag att behandlingen fungerar?
- Var kan jag hitta mer information om min sjukdom och behandling?
Källa: Socialstyrelsen. Min guide till säker vård, Utgiven 2011 och uppdaterad 2013. Den kan laddas ner eller beställas från Socialstyrelsen, Artikelnummer 2011-1-6.
Källhänvisningar
1 Chalmers 1, Glasziou P. Avoidable waste in the production and reporting of research evidence. Lancet 2009;374:86-89.
2 Roberts I, Yates D, Sandercock P, et al; CRASH trial collaborators. Effect of intravenous corticosteroids on death within 14 days in 10008 adults with clinically significant head injury (MRC CRASH trial): randomised placebocontrolled trial. Lancet 2004;364:1321-8.
3 Cochrane Injuries Group Albumin Reviewers. Human albumin administration in critically ill patients: systematic review of randomised controlled trials. BMJ 1998;317:235-40.
4 Finfer S, Bellomo R, Bryce N, et al (SAFE Study Investigators). A comparison of albumin and saline for fluid resuscitation in the intensive care unit. New England Journal of Medicine 2004;350:2247-56.
5 Edwards A, Elwyn G, Atwell C, et al. Shared decision making and risk communication in general practice – a study incorporating systematic literature reviews, psychometric evaluation of outcome measures, and quantitative, qualitative and health economic analyses of a cluster randomised trial of professional skill development. Report to Health in Partnership programme, UK Department of Health. Cardiff: Department of General Practice. University of Wales College of Medicine, 2002.
6 Farrell C, ed. Patient and public involvement in health: The evidence for policy implementation. A summary of the results of the Health in Partnership research programme. London: Department of Health Publications, April 2004. Accessed 18th January 2012.
7 Donovan J, Mills N, Smith M, et al for the ProtecT Study Group. Quality improvement report: improving design and conduct of randomised trials by embedding them in qualitative research: ProtecT (prostate testing for cancer and treatment) study. BMJ 2002;325:766-70.
8 Dickersin K, Chalmers I. Recognising, investigating and dealing with incomplete and biased reporting of clinical research: from Francis Bacon to the World Health Organization. James Lind Library, 2010. Accessed 18th January 2012.
9 Chan A-W, Hrόbjartsson A, Haahr MT, et al. Empirical evidence for selective reporting of outcomes in randomized trials: comparison of protocols to published articles. JAMA 2004;291:2457-65.
10 Chan AW, Altman DG. Epidemiology and reporting of randomised trials published in PubMed journals. Lancet 2005;365:1159-62.
11 Glasziou P, Meats E, Heneghan C, Shepperd S. What is missing from descriptions of treatment in trials and reviews? BMJ 2008;336:1472-4.
