Rättvisande behandlingsstudier
Viktiga budskap
- Välgjorda studier behövs för att vi inte ska tro att en behandling är bra när den i själva verket är dålig eller direkt skadlig, och tvärtom.
- Jämförelser är avgörande i alla behandlingsstudier.
- När man jämför behandlingsmetoder (eller när en behandling jämförs med ingen behandling) måste försöksgrupperna vara jämförbara (så lika som möjligt).
- Det är viktigt att försöka minska snedvridning vid utvärdering av behandlingsutfall.
Alla vet inte vad som kännetecknar en tillförlitlig behandlingsstudie, men egentligen är det inte särskilt komplicerat. Faktum är att vår vardagliga, intuitiva syn på världen till stor del bygger på samma grundprinciper. Trots detta tas ämnet sällan upp i skolundervisningen, och när det sker framställs det hela ofta på ett komplicerat sätt. Därför är det inte konstigt att somliga ryggar inför ämnet och tror att det är alldeles för svårt för dem. Vi tror att du snart kommer att märka att du faktiskt redan känner till de viktigaste principerna för tillförlitlighet och utan vidare inser varför de är så viktiga. Läsare som vill fördjupa sig i ämnet hittar ytterligare material på The James Lind Library.
Varför behövs rättvisande behandlingsstudier?
Kroppens egen läkande förmåga
Många hälsoproblem förvärras utan behandling, och en del blir värre trots behandling. Men ibland går krämporna över av sig själva; man kan säga att de är självläkande. En forskare som deltog i en undersökning av en ny behandling mot förkylning skämtade så här: ”Om man intensivbehandlar en förkylning går den över på sju dagar, och om man låter den vara tar det en vecka.”[1] Ett mer cyniskt talesätt är: ”Det är kroppen som läker, men läkaren som tar betalt.” Dessutom kan det ju vara så att en behandling faktiskt förvärrar situationen.
En hel del sjukdomstillstånd blir bättre även utan behandling. Det är därför som man måste ta hänsyn till sjukdomens ”naturliga” förlopp, det så kallade naturalförloppet, när man utför behandlingsstudier. Alla har ju haft halsont, magkramp eller något hudutslag som har gått över av sig självt utan någon speciell behandling. Men om man ändå hade fått behandling skulle man förmodligen ha trott att det var behandlingen som fick symtomen att försvinna. Kunskap om en sjukdoms naturliga förlopp, och sannolikheten för att den ska gå över av sig själv (spontan remission), kan förhindra onödig behandling och övertro på oprövade metoder.
När det gäller symtom som kommer och går är det extra svårt att avgöra vilken effekt olika behandlingar har. Patienter med artrit (ledinflammation) till exempel, söker oftast hjälp när sjukdomen tillfälligt blossar upp (ett skov). Oavsett om den behandling som ges är skolmedicinsk eller komplementär, verksam eller inte verksam, brukar smärtan så småningom lindras, helt enkelt för att skovet går över. Men det är förstås lätt hänt att läkare och patienter kopplar förbättringen till behandlingen, även om den inte hade något alls med saken att göra.
[…] det påstås sant och bevisat att dykare och många andra kan bota dykarsjuka genom att inta Tobak och att ingen någonsin har tagit skada av detta. Detta påstående vittnar främst om ett stort missförstånd och därefter om en monstruös absurditet: […] när en sjuk människa är som allra sjukast och i den stunden tar Tobak, och sjukdomen sedan går tillbaka på ett naturligt sätt så att personen återfår hälsan, skulle det då vara sanningen att det var Tobaken som stod bakom miraklet.”
James Stuart, King of Great Britaine, France and Ireland. A counterblaste to tobacco. I: The workes of the most high and mighty prince, James. Publicerad av James, biskop i Winton och domprost i his Majesties Chappel Royall. London: Tryckt av Robert Barker och John Bill, boktryckare för the Kings most excellent Majestie, 1616: ss. 214–222.
De positiva effekterna av optimism och önsketänkande
Idag vet vi mer om de psykologiska förklaringarna till att människor vill tro att det är behandlingen som gör att de mår bättre. Vi har alla en benägenhet att anta att om en händelse följer efter en annan, så är det den första som orsakar den andra. Vi ser gärna mönster även där de inte finns. Det kan gälla så vitt skilda områden som aktiekurser, sportprestationer och när vi singlar slant. Vi har också en benägenhet att se det vi förväntar oss att se, det vill säga vi försöker få våra förutfattade meningar bekräftade. Det kan kallas konfirmeringsfel. Allt vi ser som stöder vår uppfattning stärker alltså vår övertygelse om att vi har rätt. Samtidigt finns risken att vi inte tar in, eller inte accepterar, information som motsäger vår uppfattning utan struntar i den, ofta omedvetet.
De flesta patienter och läkare hoppas förstås att behandlingen ska hjälpa. Vi kan dra slutsatsen att någonting fungerar helt enkelt för att det stämmer med vad vi tycker borde fungera. Sådant som motsäger vår uppfattning frågar vi inte efter eller bortser från. Samma psykologiska mekanismer förklarar att den som tror att behandling ska hjälpa mycket väl kan uppleva symtomlindring även om behandlingen faktiskt saknar aktiva substanser (”sockerpiller”, sa man förr, kallas numera placebo). Man kan känna sig bättre efter att ha fått placebotabletter, injektioner med vatten, behandlingar med elektriska apparater som inte var påkopplade och kirurgiska låtsasingrepp där ingenting gjorts förutom ett litet snitt i huden och några små stygn.
Ta till exempel den undersökning som jämförde olika dieter för att gå ner i vikt. Forskarna rekryterade deltagare bland tittare som följde ett populärt teveprogram och som ville banta, och satte dem på sex olika dieter. Deltagarnas genomsnittliga kroppsvikt visade sig minska i alla sex grupperna, trots att en av dieterna, ”morotsdieten”, inte alls var en metod för viktminskning. Den hade bara tagits med som ett slags måttstock på den del av viktnedgången som berodde på andra, samtidiga förändringar av livsstilen som inte hade med själva dieterna att göra.[2]
Döm aldrig hunden efter håren
Räcker det inte att tro på behandlingen? Varför måste man göra sig besvär med, och kosta på, forskning för att försöka bedöma effekterna mer systematiskt och ta reda på om och i så fall hur väl behandlingen har fungerat? Det finns minst två skäl. Det första är att behandlingar som inte fungerar kan tränga undan behandlingar som faktiskt fungerar. Det andra är att många (eller nästan alla) behandlingar kan ge biverkningar, vissa kortsiktiga, andra långsiktiga, och somliga fortfarande oupptäckta. Patienterna ska slippa onödigt lidande. Det är därför viktigt att ta reda på vilka behandlingsmetoder som inte gör någon nytta eller som faktiskt riskerar att göra mer skada än nytta. Forskningen kan också ge viktig kunskap om behandlingarnas verkningsmekanismer så att man kan utveckla ännu bättre och säkrare metoder.
Forskning om behandlingseffekter behövs överallt, men särskilt i samhällen som strävar efter att fördela vårdens resurser rättvist via offentligt finansierad hälso- och sjukvård. Där måste man hela tiden avgöra vilka behandlingsmetoder som ger mest valuta för pengarna och gör mest nytta. Om några patienter får behandling som inte har visats hjälpa kan det innebära att andra aldrig får tillgång till åtgärder som bevisligen kunde göra nytta. Vårdens resurser är begränsade.
Det betyder inte att det är oviktigt vad patienter och vårdpersonal tänker och tror om behandlingseffekter. Tvärtom är just detta ofta utgångspunkten för forskning om nya behandlingar som bedöms vara lovande. Att följa upp sådana personliga intryck med systematiska studier kan avslöja både nytta och skada av en behandling. Ett exempel är kvinnan som hade fått läkemedlet dietylstilboestrol (DES) under sin graviditet tjugo år tidigare och som var den första som misstänkte att det kunde ha orsakat hennes dotters sällsynta vaginalcancer (se Vårdens metoder håller inte alltid vad de lovar, DES). Och när en patient beskrev att han fått oväntade biverkningar av ett nytt läkemedel mot högt blodtryck kunde varken han eller hans läkare föreställa sig att detta skulle leda fram till ett av de hittills bäst säljande läkemedlen någonsin – sildenafil (Viagra) som används för behandling av erektionsproblem.
Man får alltså inte förringa individens upplevelse av en behandlingseffekter – men det räcker sällan för att kunna dra riktiga slutsatser om effekten, än mindre för att rekommendera behandling till andra.
Vad är då en rättvisande studie?
De flesta människor vet att man inte kan tro på allt som medierna lyfter fram om nya medicinska framsteg. Tråkigt nog måste man tänka sig för även när det gäller forskningsresultat som publiceras i till synes välrenommerade vetenskapliga tidskrifter. Vilseledande och överdrivna påståenden är vardagsmat, och det är viktigt att kunna avgöra vad som är tillförlitligt.
Det finns två risker med att okritiskt lita på rapporter om behandlingseffekter. Dels riskerar man att felaktigt döma ut bra behandlingsmetoder som overksamma eller till och med farliga. Dels kan man inbilla sig att behandlingar gör nytta när de i själva verket är ineffektiva eller till och med skadliga.
En behandlingsstudie är välgjord när den har lagts upp för att göra rättvisande jämförelser. Den ska
- jämföra äpplen med andra äpplen (och inte med päron) och därmed minska risken för missvisande resultat (på grund av så kallade selektionsfel)
- räkna med slumpens inverkan
- utvärdera alla forskningsdata som är relevanta och tillförlitliga.
Det här kapitlet och de två följande tar upp dessa tre grundläggande egenskaper hos bra studier.
Jämförbart eller inte?
Jämförelser är avgörande
Rättvisande jämförelser är kärnan i vetenskapliga prövningar. Att reflektera över skillnader mellan olika behandlingar är ofta naturligt för både läkare och patienter. En viss behandlingsmetod kanske verkar ge ett annat resultat än de andra. Under medicinhistoriens gång har jämförelserna ibland gjorts mer systematiskt. Redan på 800-talet jämförde den persiske läkaren Abu Bakr Muhammad ibn Zakariyya al-Razi hur det gick för patienter med tidiga symtom (prodromalsymtom) på hjärnhinneinflammation (meningit) när de behandlades med eller utan åderlåtning. Kunde behandlingen hjälpa? Även om kraven på bevis har ökat betydligt sedan dess, hade al-Razi klart för sig att man bör göra jämförelser för att utvärdera behandlingar.[3]
Det vanliga är att man jämför grupper av patienter som behandlas med olika metoder. För att behandlingsmetoderna ska jämföras på ett korrekt sätt måste man se till att utgångsläget i alla försöksgrupper är lika, alltså att det enda som skiljer grupperna åt är själva behandlingen. Detta insåg man ganska tidigt. Innan skeppsläkaren James Lind inledde sin klassiska jämförelse av sex olika metoder mot skörbjugg ombord på HMS Salisbury, till exempel, gjorde han följande:
- valde noga ut patienter som var i samma stadium av den livshotande sjukdomen
- såg till att patienterna fick samma baskost
- inkvarterade patienterna under liknande förhållanden (se Nytt – men är det bättre?).
Lind förstod nämligen att det inte bara var själva behandlingen som påverkade chansen att tillfriskna.
En missvisande, snedvriden jämförelse hade varit att ge en av dåtidens huskurer mot skörbjugg – exempelvis svavelsyra, som på den tiden rekommenderades av Londons läkarsällskap, Royal College of Physicians of London – till sjömän som var mindre sjuka och som befann sig i ett tidigare sjukdomsstadium när studien började, och en annan behandling – till exempel citrusfrukter, som en del av besättningen föredrog – till dem som redan var döende. Detta skulle ju ha gett intrycket att svavelsyra var en bättre behandling, när den i själva verket var betydligt sämre. Sådana felaktiga resultat kan man få i en studie om inte alla omständigheter som kan påverka utfallet är desamma i de grupper som jämförs.
Behandlingar med dramatiska effekter
Det händer ibland att patienter reagerar så oväntat på en behandling, på ett sätt som avviker så tydligt från sjukdomens naturliga förlopp, att man kan sluta sig till behandlingseffekten utan att göra några särskilda studier (se Att hantera ovisshet om behandlingseffekter).[4] När en människas lunga har punkterats (så kallad lungkollaps eller pneumothorax), och man genom en nål suger ut den instängda luften, blir förbättringen så tydlig att det inte råder någon tvekan om nyttan av behandlingen. Andra exempel på dramatisk effekt är morfin vid smärta, insulin vid diabeteskoma och konstgjorda leder vid artrossmärta.
Även biverkningar kan vara dramatiska. Ibland framkallar läkemedel svåra, till och med dödliga, allergiska reaktioner. Ett annat exempel är de svåra missbildningar av armar och ben som talidomid (såldes under namnet Neurosedyn i Sverige) orsakade (se Nytt – men är det bättre?).
Men det är sällsynt att behandlingseffekter är så dramatiska. Varken positiva eller negativa effekter brukar vara så kraftfulla. Behandlingar brukar ha en mer måttlig effekt, som ändå kan vara av stort värde – även om man måste granska insatserna närmare för att upptäcka den. Det behövs till exempel noggranna forskningsstudier för att kunna avgöra vilka morfindoser som är effektiva och säkra, eller för att bedöma om konstgjort insulin är bättre än insulin från djur. Detsamma gäller frågan om huruvida en ny typ av höftprotes som är tjugo gånger dyrare än det billigaste alternativet är värd sitt pris ur patientens synvinkel. Regeln är att man måste vidta särskilda åtgärder för att undvika snedvridna jämförelser och de felaktiga beslut som kan bli följden.
Behandlingar med måttliga men viktiga effekter
Att jämföra en grupp patienter som får en viss behandling idag med en liknande grupp som fått någon annan behandling tidigare
Forskare jämför ibland en aktuell försöksgrupp, som får en ny behandlingsmetod, med tidigare likartade försöksgrupper som har fått annan slags behandling. Den typen av jämförelser med tidigare patientgrupper kan ge tillförlitliga svar när behandlingseffekterna är dramatiska – som när en ny behandling börjar rädda livet på patienter med en sjukdom som tidigare alltid lett till döden. I situationer där skillnaden mellan behandlingarna är mindre dramatisk, kan jämförelser med sådana ”historiska kontroll- grupper” bli missvisande. Även om forskarna använder metoder för statistisk korrigering och analys för att försäkra sig om att förhållandena då och nu är likvärdiga, gäller analyserna ett begränsat antal egenskaper hos patienterna. Det gör att man aldrig kan vara helt säker på att jämförelserna är rättvisande.
Problemet blir tydligt när en och samma behandling har getts till liknande patientgrupper vid olika tidpunkter. Så gjorde till exempel en forskare som analyserade 19 par studier från olika perioder av patienter med spridd lungcancer. Forskaren undersökte dödstalen bland samma typ av patienter som hade fått exakt samma behandling. Eftersom behandlingen var oförändrad borde dödligheten ha varit ungefär densamma. Men skillnaden visade sig vara avsevärd: dödligheten under ett år varierade mellan som lägst 24 procent och som högst 46 procent.[5] Skillnaden kunde absolut inte bero på att behandlingen hade ändrats – för den var precis likadan – eller på att man hade undersökt en annan kategori av patienter – för det hade man inte. I stället berodde nog de varierande dödstalen på okända skillnader mellan patienterna eller på att behandlingen ändå hade ändrats på något sätt som inte hade registrerats (bättre omvårdnad eller infektionskontroll, till exempel). Det handlade om faktorer som man inte kände till.
Att jämföra till synes liknande grupper av patienter som fått olika behandling vid samma tidpunkt
En metod som ibland används för att ställa behandlingar mot varandra är att jämföra till synes liknande grupper av patienter som fått olika behandling ungefär samtidigt. Men även detta kan vara vilseledande. Trots att tidpunkten är ungefär densamma, uppstår samma slags problem som med så kallade historiska kontrollgrupper. Vi vet ju inte om patientgrupperna som jämförs var tillräckligt lika innan de fick sina olika behandlingar – med andra ord, om grupperna verkligen är jämförbara. På samma sätt som med historiska kontrollgrupper kan forskarna med hjälp av statistiska analyser och metoder för korrigering försöka utjämna alla oavsiktliga skillnader mellan grupperna, men det kräver ju att allt som kan påverka utfallet har registrerats och tas med i beräkningen. Detta är sällsynt, så den här typen av studier bör alltid tolkas med stor försiktighet.
Ett bra exempel är hormonbehandling (HRT). I en undersökning jämfördes kvinnor som hade valt att använda HRT under klimakteriet med till synes liknande kvinnor som inte hade använt HRT. Jämförelserna tydde på att hormonbehandling minskade risken för hjärtinfarkt och stroke, vilket hade varit en mycket god nyhet om det hade stämt. Tyvärr var det inte så. Senare jämförande prövningar, som från början hade lagts upp på ett sådant sätt att jämförelsegrupperna verkligen skulle bli lika, visade att HRT hade precis motsatt effekt hos vissa patientgrupper; i själva verket ökade fallen med hjärtinfarkt och stroke (se Vårdens metoder håller inte alltid vad de lovar). Det skenbara skyddet mot hjärtinfarkt och stroke i den första undersökningen berodde på att de kvinnor som valt att använda HRT generellt sett var friskare än de som inte använde HRT. Skillnaden berodde alltså inte på hormonbehandlingen i sig. Vetenskapliga jämförelser som inte gäller jämförbara förhållanden kan skada tusentals människor.
Som erfarenheterna med HRT visar ska man sätta samman jämförelsegrupperna innan behandlingen startar. Grupperna måste bestå av patienter som liknar varandra, i fråga om kända och dokumenterade egenskaper (som kön, ålder och sjukdomens allvarlighetsgrad). Men de ska också vara lika när det gäller okända eller icke dokumenterade förhållanden som kan påverka hälsan (som kosthållning, yrke och andra sociala faktorer, oro för sjukdomen eller planerade behandlingar). Det är alltid svårt, ofta omöjligt, att vara säker på att behandlingsgrupperna är lika om de har satts samman efter att behandlingen har påbörjats.
Den avgörande frågan är alltså: beror skillnader i resultatet på skillnader som ligger i effekten av de jämförda behandlingarna eller på skillnader hos patienterna i jämförelsegrupperna?
Slumpvis och förhandsbestämd fördelning till behandlingsgrupper
Thomas Graham Balfour, militärläkare och föreståndare för ett krigsbarnhem, visade år 1854 att det går att skapa behandlingsgrupper med samma grundförutsättningar. Balfour ville ta reda på om belladonna (saften från en potatisväxt) skyddade barn mot scharlakansfeber, vilket ibland påstods. För att inte anklagas för att vinkla sitt test, ordnade han fördelningen så att vartannat barn fick läkemedlet och vartannat inte fick det.[6] Metoden kallas växelvis fördelning och är ett av flera sätt att försöka skapa jämförbara försöksgrupper, utan snedvridning – vilket är grundläggande i rättvisande behandlingsstudier. Metoden ökar sannolikheten för att jämförelsegrupperna blir lika, inte bara i fråga om kända och dokumenterat viktiga egenskaper, utan också när det gäller sådant som inte mäts men som ändå kan påverka hälsan, det vill säga skillnader som inte kan utjämnas med statistisk korrigering.
För att uppnå en jämn (det vill säga inte snedvriden) fördelning till olika behandlingar är det viktigt att de som utformar studierna ser till att varken läkaren eller patienten vet vem som får vilken behandling. Annars finns risken att de blir frestade att, medvetet eller omedvetet, välja en viss behandling. Den läkare som till exempel vet att nästa patient på deltagarlistan i en klinisk undersökning ska få placebo, kanske avråder svårt sjuka patienter från att delta i studien och väntar tills det kommer en patient som inte är lika sjuk. Även om det alltså är planerat hur fördelningen bör se ut, kan den faktiska fördelningen till olika behandlingsgrupper bara bli jämn om planen hålls dold för alla som bestämmer vilka som ska delta i studien. Då kan ingen bli frestad att avvika från den planerade fördelningen.
Dold fördelning åstadkoms oftast genom fördelningsscheman som är mindre förutsägbara än att ta varannan patient, till exempel genom att bygga fördelningen på lottning (randomisering) och genom att hålla fördelningsschemat dolt. Lottning kan till exempel göras per telefon eller via dator när det har bekräftats att en patient är kvalificerad för att delta i studien. Ett annat sätt är att använda en serie med numrerade kuvert som vart och ett innehåller information om vilken behandling som en viss patient ska få. Varje gång man tar emot en ny patient som ska delta i studien öppnas nästa kuvert i serien för att se vilken behandling som ska ges. För att det här ska fungera måste kuverten vara ogenomskinliga så att läkaren inte kan ”fuska” genom att hålla upp kuvertet mot ljuset för att se vad som står i det.

Figur 7. Dold fördelning i en studie med hjälp av randomisering per telefon
I det här exemplet får varken läkaren eller patienten veta vilken av behandlingarna i studien som tilldelas genom lottning per telefon. Det behandlingsprogram som forskaren här kallar X32 kan vara det nya läkemedlet, ett äldre preparat eller placebo. Så länge studien pågår ska varken läkaren eller patienten veta vilken behandling som ges, så kallad dubbelblindning. Om inte heller forskaren vet vilken behandling som X32 innehåller kallas det trippelblindning. Det här tillvägagångssättet anses idag vara grundläggande för att en behandlingsstudie ska bli rättvisande. Studier där behandlingar lottas kallas ”randomiserade studier” (se rutan ”Randomisering – en enkel förklaring” i Mer behöver inte vara bättre).
Olika sätt att använda lottning vid jämförelser mellan behandlingsmetoder
Det finns olika sätt att använda lottning (randomisering) för att jämföra behandlingsmetoder. Ett sätt är att i slumpvis ordning ge en och samma patient olika typer av behandlingar vid olika tidpunkter och sedan jämföra utfallet. Detta kallas randomiserad överkorsningsstudie (eller crossover-studie). För att till exempel ta reda på om ett läkemedel som man andas in (inhalerar) kan hjälpa mot ihållande torrhosta kan man utforma en studie som varar i några månader. Under ett antal slumpvis utvalda veckor får patienten använda en inhalator som innehåller ett läkemedel. Resten av tiden använder patienten en likadan inhalator som inte innehåller den substansen. Behandlingseffekten måste hinna klinga av ordentligt mellan behandlingarna, så kallad washout. När det är möjligt att skräddarsy forskning för individer på det här sättet är det bra. Men det finns många situationer där det inte går att göra överkorsningsstudier. Exempelvis kan ju operationsmetoder inte jämföras på det här sättet, och inte heller behandlingar som ges vid enstaka akuta tillstånd, som hjärtinfarkt eller stroke.
Randomisering kan också användas för att jämföra olika behandlingar som ges på olika ställen hos samma patient. När det gäller hudsjukdomar, som eksem och psoriasis, kan vissa hudpartier väljas ut slumpvis för att behandlas med en salva som innehåller ett läkemedel, medan övriga eksem hos patienten behandlas med en salva som saknar de aktiva ingredienserna. För att behandla en sjukdom i båda ögonen kan man låta lotten avgöra vilket öga som behandlas på det ena eller andra sättet och jämföra resultatet.
Ett annat sätt att randomisera är att jämföra olika typer av behandlingar som ges till olika grupper, så kallade populationer, till exempel alla personer som besöker vissa inlottade vårdcentraler eller sjukhus. När man använder sådana jämförelser kallas det klusterrandomisering eller grupprandomisering. Forskarna som utvärderade det mexikanska försäkringsprogrammet för den offentliga hälso- och sjukvården matchade till exempel 74 par regioner med olika upptagningsområden, kluster, som tillsammans representerade 118 000 hushåll i sju stater. Inom varje matchat par lottades den ena in till att ingå i försäkringsprogrammet.[7]
Men det absolut vanligaste sättet att använda randomisering är att de behandlingsmetoder som jämförs lottas till olika försöksdeltagare.
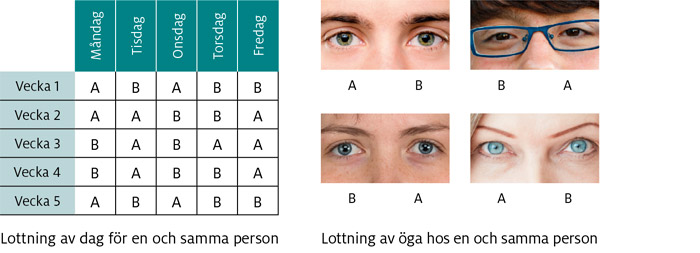
Figur 8. Möjligheter att använda randomisering
Uppföljning av samtliga deltagare i jämförande studier
Eftersom forskarna måste anstränga sig för att skapa jämförbara försöksgrupper där deltagarna har likvärdiga grundförutsättningar, är det, när resultaten analyseras, viktigt att försöksdeltagarna inte har bytt grupp eller fallit bort. Annars kan resultatet bli felaktigt. Så långt det är möjligt ska alltså alla försöksdeltagare följas upp och räknas till den försöksgrupp som de ursprungligen skulle tillhört, oavsett vilken behandling de senare faktiskt fick (om alls någon). Detta kallas ”intention-to-treat”-analys.
Det kan låta ologiskt att jämföra försöksgrupper där vissa patienter inte fick avsedd behandling, men om man frångår principen ”intention-to-treat” kan resultaten bli missvisande. Ett exempel: Patienter som har delvis igensatta blodkärl till hjärnan och som får svimningsattacker löper högre risk än andra att drabbas av stroke. En studie skulle undersöka om operation för att avlägsna tilltäppningar i blodkärlen kunde minska risken för stroke. Klokt nog jämförde forskarna samtliga som hade ingått i operationsgruppen med samtliga patienter som inte opererades. Hade forskarna nöjt sig med att räkna stroke bland dem som fortfarande levde när studien avslutades skulle de ha missat något väsentligt – att själva ingreppet kunde medföra stroke och död. Bland överlevarna förekom visserligen färre fall av stroke än i jämförelsegruppen, men det skulle ha varit en missvisande slutsats, eftersom riskerna med själva operationen måste ingå när behandlingen utvärderas.
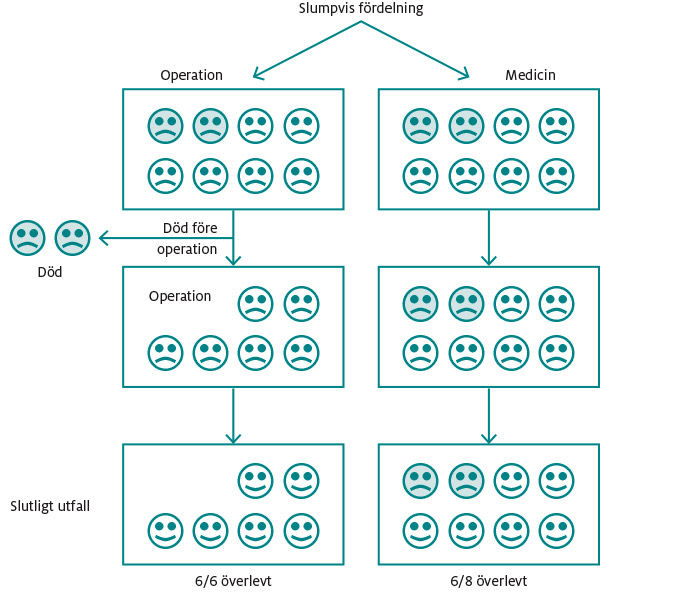
Figur 9. Orsaken till att alla slumpvis fördelade patienter ska finnas med i det slutliga resultatet (”intention to treat”-analys)
Figur 9 visar att utfallet av operation och medicinsk behandling i det här fallet faktiskt är detsamma. Men om de två personer som hamnade i operationsgruppen och som dog före operationen sedan inte skulle tas med i utvärderingen skulle jämförelsen mellan de båda grupperna bli snedvriden. Då skulle operation ha verkat vara bättre, trots att det inte är så.
Att hantera avvikelser från den planerade behandlingen
Utifrån det som hittills har sagts i det här kapitlet är det uppenbart att rättvisande studier måste planeras noga. Planerna kallas forskningsprotokoll. Men inte ens de bästa protokollen fungerar alltid som forskarna har tänkt.
Ibland får patienterna en annan behandling än den planerade. Patienten kanske inte följer rekommendationerna, eller någon av behandlingarna kanske inte kan ges på grund av brist på resurser eller personal. Om sådana avvikelser upptäcks måste forskarna noggrant överväga och hantera följderna.
Under 1970- och 1980-talen gjordes anmärkningsvärda framsteg i behandlingen av barn med akut lymfoblastisk leukemi, den vanligaste formen av leukemi i denna åldersgrupp. Det märkliga var att amerikanska barn klarade sig betydligt bättre än brittiska barn, trots att de ytligt sett verkade genomgå exakt samma behandlingsprogram.[8] Under ett besök på en barncancerklinik i Kalifornien lade en uppmärksam brittisk statistiker märke till att cytostatika gavs på ett mycket ”aggressivare” sätt till de amerikanska barnen med leukemi än till barnen i Storbritannien. Behandlingen hade mycket obehagliga biverkningar (illamående, infektioner, blodbrist, håravfall med mera) och när dessa blev särskilt besvärliga hade de brittiska läkarna och sjuksköterskorna, till skillnad från sina amerikanska kollegor, en benägenhet att dra ner på eller göra uppehåll i behandlingen. Denna ”snällare” attityd tycks ha försämrat behandlingens effekt och var troligen förklaringen till skillnaderna i resultat.
Att hjälpa de berörda att hålla sig till den tilldelade behandlingen
Skillnader mellan avsedd och faktisk behandling i jämförande studier kan uppstå även på andra sätt, vilket försvårar tolkningen av resultaten. Försöksdeltagare ska inte nekas behandling som är medicinskt nödvändig. När en ny och lovande – men obevisad – behandling testas i en välgjord studie ska därför alla deltagare få en försäkran om att alla kommer att få en behandling som är effektiv och etablerad, när studien är avslutad.
Om alla som är inblandade i en studie känner till vem som får vilken behandling, uppstår risk för snedvridning på flera sätt. Patienter och läkare som lottats till den ”nya” behandlingsmetoden kanske tycker att de har haft tur, och omedvetet överdriver de positiva effekterna. Omvänt kan de som har tilldelats en ”äldre” behandling känna att de har haft otur, och besvikelsen kan få dem att underskatta eventuella positiva effekter. På motsvarande sätt kan deras uppfattning om biverkningar påverkas. Det kan därför hända att läkare som känner till vilka som fått den äldre behandlingen ger extra behandling eller omvårdnad, som ett slags kompensation. Att ge sådan tilläggsbehandling till patienter i en av jämförelsegrupperna men inte i den andra försvårar tolkningen av forskningsresultaten. Det riskerar att göra jämförelsen skev och resultatet missvisande. Ett sätt att undvika sådana problem är att dölja vilken av behandlingarna som ges. Det betyder att man måste försöka se till att den nya och den gamla behandlingen har samma utseende, smak och lukt, så att varken läkaren eller patienten kan ana vilket av preparaten det handlar om.
Så ska det också gå till när man jämför ett nytt läkemedel som man hoppas ska fungera med en placebotablett: den ska ha utformats för att se ut, lukta och smaka som den ”riktiga” medicinen. Att hemlighålla behandlingsmetod på det här sättet kallas blindning eller maskering. Om man lyckas åstadkomma blindning (i många fall är det omöjligt), finns det goda chanser att patienterna i de båda jämförelsegrupperna bara skiljer sig åt i fråga om själva behandlingen. Helst ska inte heller vårdpersonalen kunna avgöra vilka patienter som har fått vilken behandling. Att varken läkaren eller patienten vet vilken av behandlingarna som ges kallas dubbelblindning. Då är patienterna i båda jämförelsegrupperna lika motiverade att fortsätta med den behandling som de har tilldelats, samtidigt som chansen är större att vårdpersonalen behandlar alla lika. Om behandlingen är maskerad även för en tredje part som bedömer effekten, kallas detta för trippelblindning.
Rättvisande mätning av behandlingsutfall
Ett av skälen till att man använder placebo vid jämförelser av olika behandlingar är att det blir lättare för patienter och läkare att hålla sig till de behandlingar de blivit tilldelade. Ett annat viktigt skäl för sådan ”blindning” är att minska risken för snedvridning när behandlingsresultatet ska registreras.
Detta har en intressant historia. På 1700-talet krävde Ludvig XVI i Frankrike en undersökning för att kontrollera Anton Mesmers påståenden om att så kallad animal magnetism (ibland kallat mesmerism) hade positiva effekter. Metoden innebar att patienten ombads vidröra särskilda metallrör. Kungen ville veta om metodens verkan berodde på en ”verklig kraft” eller bara på ”sinnesvillor”. Testet gick till så att ett antal personer med bindel för ögonen fick höra att de utsattes eller inte utsattes för metoden, men i själva verket förhöll det sig ofta tvärtom. Resultatet visade att bara de som hörde att de fick behandlingen upplevde några effekter.
När det gäller vissa behandlingsresultat, till exempel överlevnad, är sannolikheten mycket liten för mätproblem – det är ju uppenbart om någon har dött eller inte. Annars brukar mätning ge ett utrymme för tolkning – till exempel när man ska skatta svårighetsgraden av subjektiva symtom, som smärta och oro. Då kan förväntningar hos både patienter och vårdpersonal påverka skattningen. Den som till exempel har positiva förväntningar på någon av de behandlingar som undersöks, blir ofta extra uppmärksam på dess fördelar. Omvänt blir man mer benägen att se nackdelarna med en behandling som man inte riktigt tror på.
Eftersom sådana feltolkningar är så vanliga, ska välgjorda studier använda blindning. De olika behandlingar som jämförs ska utåt sett vara så lika som möjligt. I till exempel en undersökning av multipel skleros, MS, blev alla patienter undersökta av dels en läkare som inte visste om patienterna hade fått ett nytt läkemedel eller placebo (läkaren var alltså ”blindad”), dels en läkare som visste vilken jämförelsegrupp patienten hade lottats till (läkaren var ”oblindad”). Blindade läkare bedömde att den nya behandlingen var ineffektiv, medan oblindade ansåg att den nya behandlingen hade positiva effekter.[9] Läkare som gjorde bedömningen förutsättningslöst konstaterade alltså att behandlingen inte var effektiv, medan läkare som såg vilken behandling som gavs fann just det som de förväntade sig eller hoppades på. Tumregeln är att ju mer det krävs av värdering och tolkning av behandlingsresultaten, desto större är behovet av blindning – annars kan resultatet bli missvisande.
I vissa studier lyckas man till och med dölja för patienterna huruvida de har opererats eller inte. I en sådan studie av att spola ledhålan vid artros i knäleden genomgick vissa av patienterna ett riktigt ingrepp där den drabbade leden faktiskt spolades igenom, medan andra patienter bara fick ett enkelt snitt i huden över knäet för att det skulle se ut som om man hade gjort en spolning. Studien visar att det inte verkar finnas någon uppenbar fördel med ingreppet.[10]
Ofta är det helt enkelt omöjligt att dölja för patienten och läkaren vilken av behandlingarna som ges i studien. Det gäller till exempel när man jämför operation och läkemedelsbehandling eller när ett läkemedel har speciella biverkningar som är lätta att känna igen. Men i många situationer där en feltolkning skulle kunna smyga sig in, till exempel när man ska bedöma dödsorsak eller tolka röntgenbilder, kan man åstadkomma en mer objektiv bedömning genom att fråga läkare som inte vet vilken behandling patienten fått.
Att upptäcka och utreda misstankar om oväntade biverkningar
Hur misstankar om oväntade biverkningar uppstår
De som först brukar ana att en viss behandling har oförutsedda effekter, positiva eller negativa, är vårdpersonal och patienter.[11] De behandlingsstudier som krävs för att få tillstånd att marknadsföra ett läkemedel omfattar bara några hundra eller några tusen personer som får behandlingen under några månader, och det gör att bara relativt kortvariga och vanliga biverkningar fångas upp i det här skedet. Sällsynta effekter, och sådana som behöver längre tid för att utvecklas, upptäcks inte förrän behandlingen har blivit mer spridd och har använts under en längre tidsperiod och av en brokigare skara patienter.
Flera länder, som Sverige, Danmark, Norge, Storbritannien och USA, har skapat system för att läkare och patienter ska kunna rapportera misstänkta läkemedelsbiverkningar, som sedan kan undersökas systematiskt.[12] Även om dessa rapporteringssystem inte så ofta har lyckats upptäcka viktiga biverkningar av läkemedel, finns det exempel på att så faktiskt har skett. När det antidepressiva läkemedlet zimelidin lanserades i Sverige 1982 kom snart rapporter om att patienter drabbats av det mycket sällsynta tillståndet Guillain-Barrés syndrom, en allvarlig nervsjukdom. Detta ledde till att läkemedlet drogs in 1983.
Att utreda misstankar om oväntade biverkningar
Misstankar om biverkningar visar sig ofta vara falskt alarm.[11] Hur går man då till väga för att ta reda på om misstankarna stämmer?
Utredningen måste följa samma principer som när man kartlägger förväntade positiva behandlingseffekter. Man måste försäkra sig om att fallen är jämförbara och ta med tillräckligt många.
På samma sätt som för önskade effekter, är oväntade biverkningar lättare att upptäcka och belägga om de är dramatiska. Om ett visst symtom i vanliga fall är mycket sällsynt, och detta symtom plötsligt drabbar många patienter när en behandling har införts i stor skala, kan både vården och patienterna börja misstänka att det handlar om en biverkan. I slutet av 1800-talet fick den schweiziske kirurgen Theodor Kocher veta av en allmänläkare att en av flickorna som tidigare hade fått sköldkörteln bortopererad av Kocher sedan några år tillbaka var matt och slö. När han analyserade fallet närmare och undersökte andra patienter med struma som han opererat på samma sätt, upptäckte han att ingreppet bland annat hade lett till myxödem – ett allvarligt tillstånd som orsakas av brist på sköldkörtelhormon, vilket vi numera vet.[13] De oförutsedda effekterna av talidomid (Neurosedyn, se Nytt – men är det bättre?) var också något som misstänktes och kunde bekräftas – kopplingen mellan läkemedelsanvändning under graviditeten och barn födda utan armar och ben var uppenbar. Den typen av missbildningar hade i stort sett aldrig setts tidigare.
![]() BIVERKNINGSRAPPORTERING I SVERIGE
BIVERKNINGSRAPPORTERING I SVERIGE
Den första misstanken om en ny, allvarlig biverkan av ett läkemedel brukar väckas genom att en enskild läkare, tandläkare, sjuksköterska eller farmaceut observerar något oväntat hos en eller ett par patienter och rapporterar detta till Läkemedelsverket. Den som använder ett läkemedel kan också själv rapportera, men sjukvården har skyldighet att rapportera alla biverkningar oavsett om konsumenten också gör det. Syftet med rapporterna är att snabbt fånga upp misstankar om nya biverkningar eller olämpliga kombinationer av läkemedel.Hos Läkemedelsverket utreds misstanken vidare tillsammans med annan tillgänglig information. Genom det läkemedelsregister som finns på Socialstyrelsen kan myndigheterna till exempel ta reda på hur många som kan ha drabbats. Det finns också ett samarbete inom EU. Inom 15 dagar ska läkemedelstillverkaren och de andra medlemsstaterna informeras om allvarliga biverkningar som inträffat i något EU-land.I Sverige rapporterar man biverkningar till Läkemedelsverket eller per post.
Källa: Läkemedelsverket
Ibland kan oväntade biverkningar uppdagas i randomiserade prövningar som jämför nyttan av olika behandlingsmetoder. I en randomiserad studie gavs två typer av antibiotika till nyfödda för att förhindra infektioner, varav det ena var ett sulfapreparat. Det visade sig att ett av läkemedlen påverkade kroppens nedbrytning av bilirubin, en slaggprodukt från blodets hemoglobin. Ansamlingen av den här slaggprodukten i blodet ledde till hjärnskador hos spädbarn som hade fått det ena läkemedlet i jämförelsen, nämligen sulfapreparatet.[14]
Ibland kan efterhandsanalyser av randomiserade prövningar bidra till att avslöja biverkningar. När man hade påvisat att läkemedlet dietylstilbestrol (DES), som getts till gravida kvinnor på 1950-talet, hade orsakat cancer hos några av deras döttrar förekom spekulationer om andra möjliga biverkningar. Genom att i uppföljande studier kontakta sönerna och döttrarna till de kvinnor som hade deltagit i kontrollerade prövningar upptäcktes missbildningar i könsorganen och infertilitet hos både män och kvinnor. Ett annat och nyare exempel är rofecoxib (Vioxx) som hade lanserats för reumatoid artrit (ledgångsreumatism), men som man misstänkte kunde orsaka hjärtinfarkt. En mer detaljerad genomgång av resultaten från relevanta, randomiserade studier bekräftade att läkemedlet faktiskt hade sådana skadeverkningar (se Nytt – men är det bättre?).[15]
Att analysera biverkningar hos patienter som deltagit i randomiserade undersökningar är naturligtvis bra på så sätt att jämförbarheten mellan behandlade och icke-behandlade är god. Det är viktigt att alla patienter är noggrant registrerade så att man vid behov kan göra långtidsuppföljningar. Det visar exemplet med antibiotikabehandling av gravida kvinnor för att förebygga för tidig förlossning (se Att hantera ovisshet om behandlingseffekter).
Det är enklare att utreda misstänkta biverkningar om dessa skiljer sig tydligt från det tillstånd som behandlingen riktas mot.[16] När Benjamin Spock till exempel rekommenderade att spädbarn ska sova på mage gällde detta alla spädbarn, inte bara dem som man misstänkte löpte större risk för plötslig spädbarnsdöd (se Vårdens metoder håller inte alltid vad de lovar). Eftersom rådet om magläge fick en så oväntad följdverkan som plötslig spädbarnsdöd, stärkte detta slutsatsen att ökningen av sådana dödsfall faktiskt orsakades av just magläget och inte några andra omständigheter.
Däremot var det mycket svårare att till exempel undersöka misstanken om att vissa läkemedel mot depression kunde leda till mer självmordstankar hos barn och ungdomar. Sådana tankar kan ändå förekomma vid depression.[17] Dessa läkemedel undviks idag för barn och unga.
Eftersom läkemedelsbiverkningar kan likna sjukdomssymtom, är det alltså viktigt att läkaren tänker på läkemedelsbiverkningar som en möjlig förklaring.
Källhänvisningar
1 Hopkins WA. Patulin in the common cold. IV. Biological properties: extended trial in the common cold. Lancet 1943;ii:631-5.
2 Sanders TAB, Woolfe R, Rantzen E. Controlled evaluation of slimming diets: use of television for recruitment. Lancet 1990;336:918-20.
3 Tibi S. Al-Razi and Islamic medicine in the 9th Century.
4 Glasziou P, Chalmers I, Rawlins M, et al. When are randomised trials unnecessary? Picking signal from noise. BMJ 2007;334: 349-51.
5 Pocock SJ. Randomised clinical trials. BMJ 1977;1:1661.
6 Balfour TG. Quoted in West C (1854). Lectures on the Diseases of Infancy and Childhood. London: Longman, Brown, Green and Longmans, p600.
7 King G, Gakidou E, Imai K, et al. Public policy for the poor? A randomised assessment of the Mexican universal health insurance programme. Lancet 2009;373:1447-54.
8 Peto J, Eden OB, Lilleyman J, et al. Improvement in treatments for children with acute lymphoblastic leukaemia: The Medical Research Council UKALL Trials, 1972-84. Lancet 1986;i:408-11.
9 Noseworthy JH, Ebers GC, Vandervoort MK, et al. The impact of blinding on the results of a randomized, placebo-controlled multiple sclerosis clinical trial. Neurology 1994;44:16-20.
10 Moseley JB, O’Malley K, Petersen NJ, et al. A controlled trial of arthroscopic surgery for osteoarthritis of the knee. New England Journal of Medicine 2002;347:81-8.
11 Venning GR. Validity of anecdotal reports of suspected adverse drug reactions: the problem of false alarms. BMJ 1982;284:249-54.
12 McLernon DJ, Bond CM, Hannaford PC, et al on behalf of the Yellow Card Collaborative. Adverse drug reaction reporting in the UK: a retrospective observational comparison of Yellow Card reports submitted by patients and healthcare professionals. Drug Safety 2010;33:775-88.
13 Kocher T. Ueber Kropfexstirpation und ihre Folgen. Archiv für Klinische Chirurgie 1883;29:254-337.
14 Silverman WA, Andersen DH, Blanc WA, et al. A difference in mortality rate and incidence of kernicterus among premature infants allotted to two prophylactic regimens. Pediatrics 1956;18:614-25.
15 Zhang J, Ding E, Song Y. Adverse effects of cyclooxygenase 2 inhibitors on renal and arrhythmia events: meta-analysis of randomized trials. JAMA 2006;296:1619-21.
16 Vandenbroucke JP, Psaty BM. Benefits and risks of drug treatments: how to combine the best evidence on benefits with the best data about adverse effects. JAMA 2008;300:2417-9.
17 Whittington CJ, Kendall T, Fonagy P, et al. Selective serotonin reuptake inhibitors in childhood depression: systematic review of published versus unpublished data. Lancet 2004;363:1341-5.
